
62
Científica Tropical (IICT), foram identificadas as espécies
vegetais e herborizaram-se exemplares representativos, re-
ferenciando-se o coletor, número, local e data de colheita,
tendo sido depositados no Herbário do IICT em Lisboa, as-
segurando deste modo a sua conservação, validando os
espécimes e a origem geográfica das plantas em estudo.
As folhas de
M. pulegium
(poejo) de CaboVerde e Portugal
e a parte aérea de
F. vulgare
(funcho) de Cabo Verde de-
pois de secas à temperatura ambiente e no escuro, foram
submetidas a processos de extração dos óleos essenciais
(OEs), por hidrodestilação, utilizando um aparelho de
Clevenger modificado. Pelo facto do funcho ter um bai-
xo rendimento optou-se por utilizar o óleo essencial co-
mercial de
F. vulgare
de Portugal, adquirido na Terra Pura,
Segredo da Planta.A obtenção dos extratos de folhas de
S.
nigra
,
M. azedarach
e
A. indica
foi feita com solventes de di-
ferentes polaridades (hexano, acetato de etilo e etanol).A
preparação dos extratos desenvolveu-se em 4 fases: seca-
gem, extração, filtração e evaporação. Todos os trabalhos
de secagem, produção de óleos e extratos vegetais de-
correram no laboratório de Ecofisiologia e Biotecnologia
(URGENP) do INIAV, em Oeiras.
As colónias de
An. arabiensis
, estirpe Dongola (ovos ce-
didos pela Agência Atómica Europeia), originária do
Sudão e de
Ae. aegypti
originária de Cabo Verde, foram
implementadas e mantidas ao longo de várias gerações
em condições otimizadas de temperatura, humidade rela-
tiva e fotoperíodo nos insectários da Unidade de Ensino
e Investigação de Parasitologia Médica do IHMT em
Lisboa.
Os bioensaios de atividade larvicida foram efetuados
de acordo com os testes padronizados da Organização
Mundial da Saúde [17; 18; 19].
As condições ambientais durante a fase de criação e bio-
ensaios de sensibilidade foram constantes, de 26±2ºC de
temperatura, 80±10% de humidade relativa e um foto-
período de 12 horas de escuro/luz, estando os adultos de
Ae. aegypti
acondicionados em câmara de segurança.
Para a preparação dos ensaios com OE’s foi necessária a
adição do tensioativo Tween® 20, de modo a obter uma
emulsão otimizada do produto em água. Para tal foi pre-
viamente testada uma gama de concentrações deste ten-
sioativo de modo a eliminar qualquer efeito tóxico even-
tual do mesmo sobre as larvas.
Os óleos essenciais cujas propriedades larvicidas foram
avaliadas, foram em seguida analisados por espectrosco-
pia de Ressonância Magnética Nuclear (RMN de
13
C),
de modo a identificar os seus constituintes maioritários.
Os extratos vegetais de acetato de etilo
S. nigra
por te-
rem revelado atividade larvicida, foram analisados por
cromatografias de TLC (cromatografia de camada fina) e
fraccionados por cromatografia de coluna (CC) para pos-
teriormente serem analisados por Cromatografia Líquida
de Alta Resolução (HPLC), de modo a caraterizar o perfil
químico da planta, dados não apresentados neste artigo.
Os resultados dos bioensaios de determinação do nível
de sensibilidade aos extratos, óleos essenciais e seus com-
postos ativos foram analisados estatisticamente com re-
curso aos programas Microsoft Excel ® 2010 e SPSS®
paraWindows, versão 21.
Resultados e discussão
Os óleos essenciais de
F. vulgare
e de
M. pulegium
reve-
laram atividade larvicida, 24h após o início do ensaio.
Atingiu-se, aproximadamente, 100% de mortalidade das
larvas de
Ae. aegypti
com 52,4μl/l do óleo de funcho (
F.
vulgare
) de Portugal comparativamente aos 37,1μl/l do
funcho Cabo-Verde (Tabela 1). Este resultado confirmou
os efeitos larvicidas do óleo essencial de
F. vulgare
referi-
dos por Chung
et al
., 2011, que obtiveram efeito tóxi-
co considerável com esta mesma planta nas larvas do 4º
estádio de
Ae. aegypti
com CL
50
de 41,23ppm e CL
90
de
65,20ppm [20].
As diferenças de atividade observadas com os OEs do
F.
vulgare
de Portugal e CaboVerde devem-se, provavelmen-
te, às caraterísticas edafoclimáticas das duas regiões, o
que confirma a teoria de Sukumar
et al
1991, segundo a
qual a origem geográfica das plantas condiciona a bioati-
vidade das mesmas [21].
Os resultados obtidos comprovam ainda efeito larvicida
de OE de
M. pulegium
de Portugal (CL
99
-189,6µl/l) e de
Cabo-Verde (CL
99
-223,96µl/l), sendo o OE desta planta
menos ativo comparativamente ao do
F. vulgare
.
A análise por
13
C RMN do OE de
M. pulegium
de Portugal
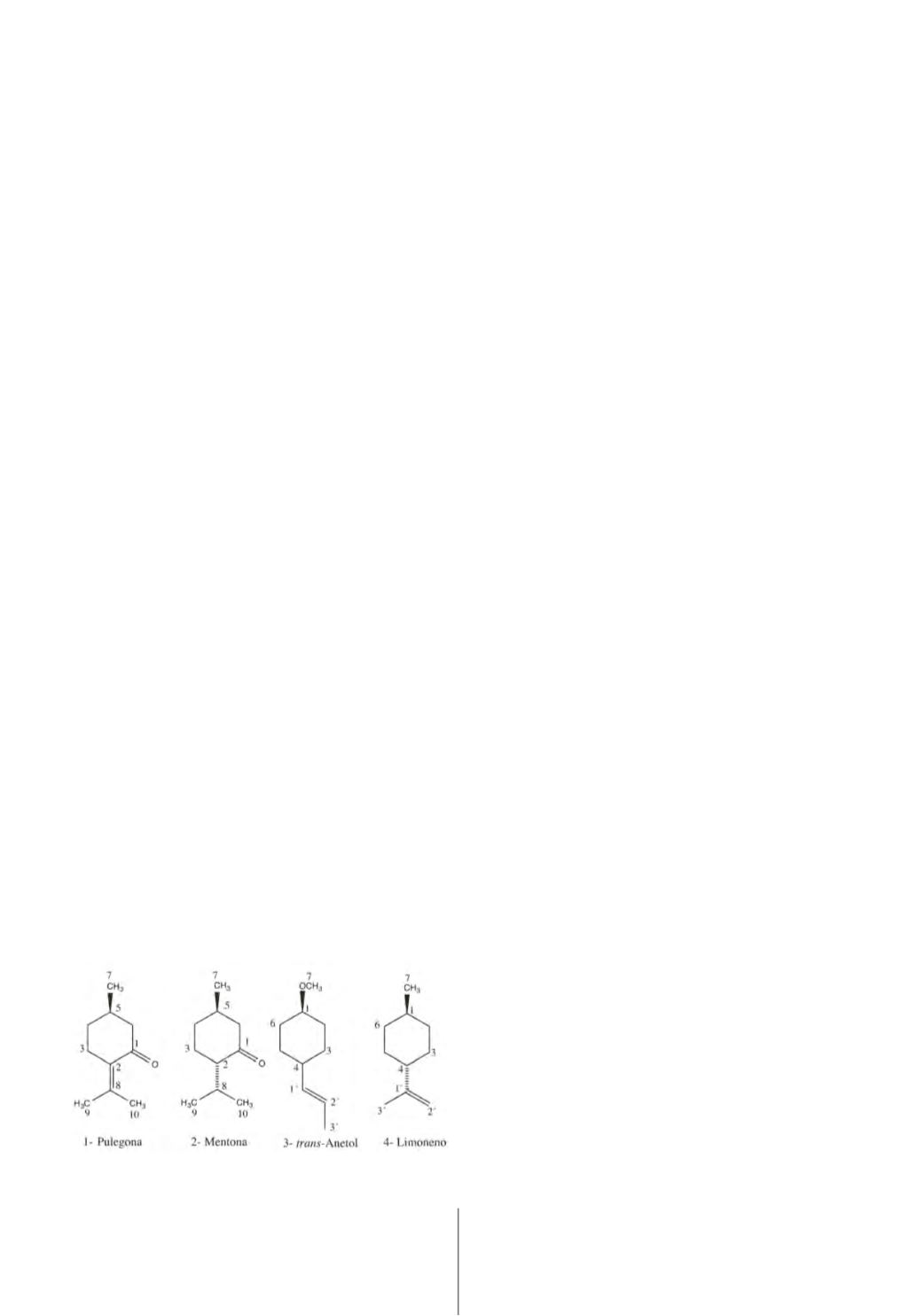
(Tabela 2) mostrou que a pulegona1 (Figura 2) é o seu
principal composto, seguido de mentona, enquanto no
OE de Cabo Verde foram detetados vestígios de pulego-
na sendo este óleo uma mistura complexa de mentona2,
mentol entre outros compostos terpénicos. A pulegona1
foi também o composto maioritário detetado no OE co-
mercial do poejo. Relativamente à constituição do OE de
F. vulgare
de Cabo Verde, o
trans-
anetol3 e o limoneno4
(Figura 2) são os principais constituintes identificados na
análise de RMN de
13
C (Tabela 3). A análise do OE de fun-
Fig. 2 -
Estrutura química dos principais compostos que constituem os OEs
da
M.pulegium e F.vulgare.
Artigo Original


















