
24
com amostras biológicas. Além disso apresenta um baixo
custo, comparativamente com a nitrocelulose, o suporte
mais comum em TDR [19,20]. A tecnologia
lab-on-paper
tem sido grandemente aplicada na deteção de glucose,
ácidos nucleicos de
Mycobacterium tuberculosis
e anticorpos
anti-Leshmania
. A sua aplicação tem também sido promis-
sora nas áreas da qualidade alimentar e da monitorização
ambiental [19,20].
A tecnologia
lab-on-paper
baseia-se num método simples e
não dispendioso de padronização do papel, formando ca-
nais delimitados por um polímero hidrofóbico. O método
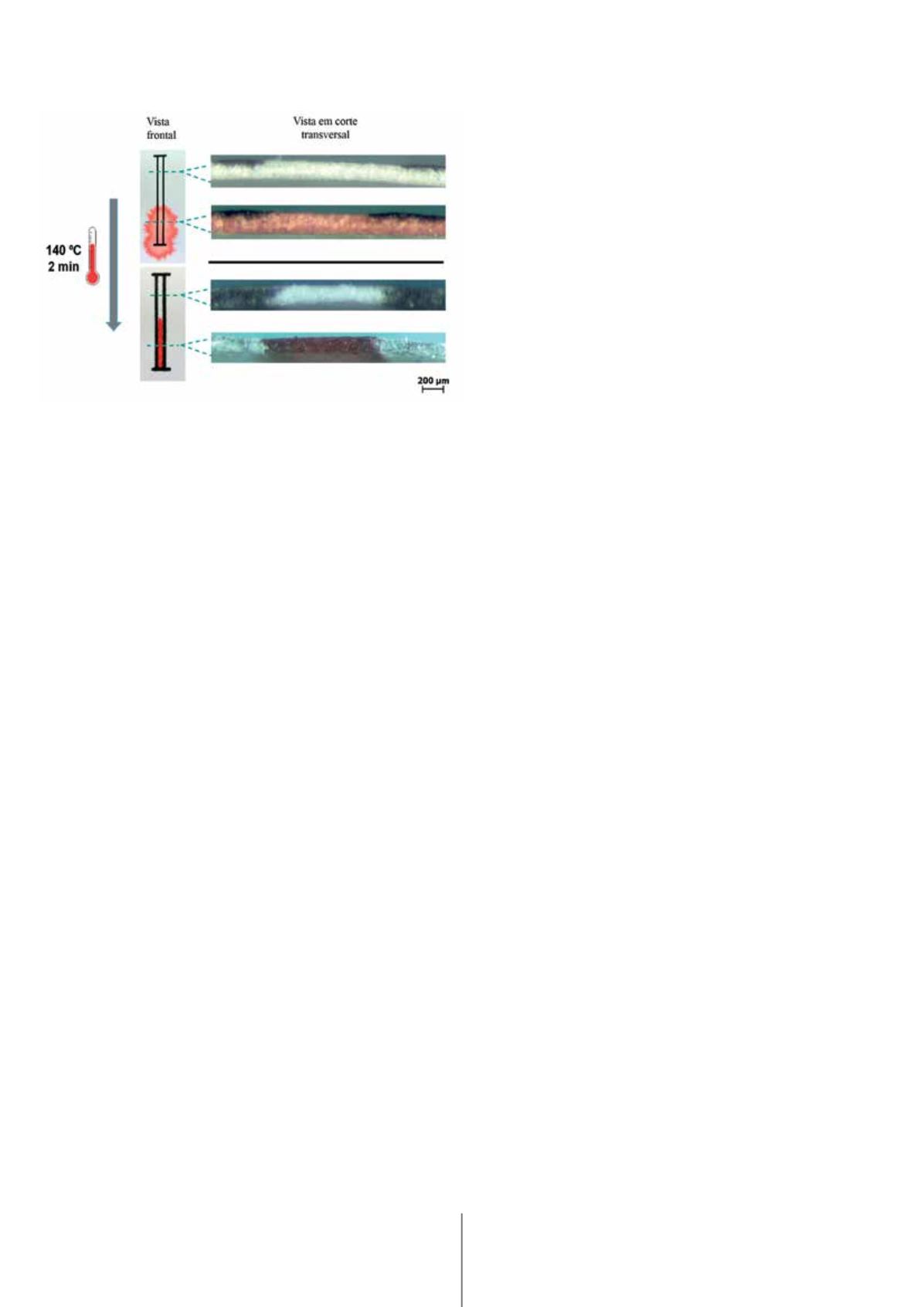
usa uma impressora convencional com tinteiros de cera e
uma placa de aquecimento. O padrão desejado é impresso
em cera na superfície do papel, e através do uso de uma
placa de aquecimento, a cera derrete e difunde ao longo
da espessura do papel, criando barreiras hidrofóbicas que
definem canais hidrofílicos e zonas de reação (linha de teste
e linha de controlo), tal como ilustra a figura 2.
A aplicação desta tecnologia ao TDR para diagnóstico de
malária será vantajosa comparativamente com os testes
disponíveis comercialmente, pois elimina-se a necessidade
do invólucro de plástico e usa-se um pequeno volume de
amostra, o que diminui o seu custo. Estas condições su-
gerem a aplicação deste TDR em amostras clínicas, assim
como seria interessante provar a sua aplicabilidade nas con-
dições adversas de diagnóstico "
point-of-care
".
Materiais e métodos
Reagentes
O anticorpo monoclonal anti-
Pf
HRP2 foi obtido comercial-
mente da empresa antibodies-online GmbH. O anticorpo se-
cundário, anti-IgG de ratinho foi adquirido a Sigma-Aldrich
e os reagentes usados nos géis de SDS-PAGE foram de BIO-
-RAD. A agarose UltraPura (Invitrogen) foi usada nos géis de
agarose. As membranas de nitrocelulose foram de Life Scien-
ces. O papel de filtro foi papel de cromatografiaWhatman Nº
1.Todos os outros reagentes químicos foram de Sigma-Aldri-
ch, com elevado grau de pureza.
Síntese e Funcionalização de AuNP
As nanopartículas de ouro com um diâmetro médio de 13
nm foram sintetizadas pelo método de redução de um sal
de ouro pelo citrato de sódio. Este método foi original-
mente descrito por Turkevich [21] e posteriormente oti-
mizado por Plech e colaboradores [22].
A concentração da solução coloidal de AuNP foi determi-
nada por espectrofotometria de UV-visível como anterior-
mente descrito [23].
De forma a uniformizar a carga negativa da superfície das
AuNP e facilitar a conjugação com o anticorpo, o reves-
timento de citrato de sódio proveniente da síntese foi
substituído pelo ácido 11-mercaptoundecanóico (MUA)
ou pelo pentapéptido CALNN. A solução coloidal de
AuNP foi incubada durante 2 horas à temperatura ambien-
te com MUA, numa razão molar 1:5000 e com CALNN
num período de 16 horas numa razão molar de 1:1000.
As partículas funcionalizadas foram submetidas a ciclos de
centrifugação/ressuspensão de forma a remover o ligando
que não reagiu.
As AuNP funcionalizadas foram caracterizadas por espec-
trofotometria de UV-visível num intervalo de comprimen-
to de onda de 300 a 900 nm e por eletroforese em gel de
agarose.
Preparação dos bionanoconjugados AuNP-anti-
corpo e AuNP-anticorpo-antigénio
A formação dos bionanoconjugados AuNP-MUA ouAuNP-
-CALNN com o anticorpo anti-
Pf
HRP2 (AuNP-MUA-an-
ti-
Pf
HRP2 ou AuNP-CALNN-anti-
Pf
HRP2) foi realizada
na presença e na ausência dos agentes de reticulação EDC
(cloridrato de 1-etil-3-(3-dimetilaminopropil) carbodiimi-
da e NHS (N-hidroxisuccinimida). As soluções de EDC e
NHS foram preparadas pela dissolução dos respetivos sais
em água milli-Q, obtendo-se num volume final de 1 mL,
uma concentração de EDC e de NHS de 1 mM e 2 mM
respetivamente. As soluções aquosas de EDC/NHS foram
incubadas com as AuNP funcionalizadas, durante 1 hora, à
temperatura ambiente.
Adicionaram-se diferentes razões molares de anticorpo an-
ti-
Pf
HRP2 a AuNP-MUA ou AuNP-CALNN a 1nM para os
estudos de eletroforese em gel de agarose ou a 2,5 nM para
o desenvolvimento do TDR. Os conjugados foram incuba-
Figura 2
–
Imagens de microscopia ótica da secção transversal do papel,
antes e depois da difusão da cera através de toda a espessura do papel. A
fim de realçar o efeito das barreiras hidrofóbicas foi utilizada uma solução
de corante vermelho.
Artigo Original


















